随着铜绿假单胞菌(Pseudomonas aeruginosa)耐药性变得日趋严重,临床有效抗生素数量逐步减少,迫切需要新的治疗措施和药物。2022年8月来自哈佛医学院的Vijay K. Singh及其团队在nature communications(IF=17.694)期刊上发表了题为“Tackling recalcitrant Pseudomonas aeruginosa infections in critical illness via antivirulence monotherapy”的研究论文。他们发现危重患者中随着肠道屏障的破坏,肠道细菌及其毒力因子会转移到全体循环,而铜绿假单胞菌的继发感染会增加肠道渗透性,并引起败血症。由于铜绿假单胞菌多重耐药性、生物膜形成和抗生素耐受性等特征,铜绿假单胞菌引起的感染治疗极具挑战性。通过抑制群体感应系统转录调节因子MvfR(PqsR),成为一种理想的铜绿假单胞菌抗毒力策略,因为MvfR控制着多种急性和慢性毒力功能。
该究展示了MvfR促进肠道渗透性的作用,并报告了强效的抗MvfR化合物, N-Aryl Malonamides(NAMs)。这些化合物通过了广泛的构效关系研究和对MvfR控制的毒力功能抑制评估。这类化合物是MvfR非天然配体,具有纳摩尔级的半数抑制浓度和强大的靶点结合能力。使用NAMs的单药疗法可保护小鼠肠道屏障功能,消除MvfR调控的小分子物质,改善细菌扩散,并降低炎症细胞因子。这项研究证明了MvfR在铜绿假单胞菌驱动的肠道渗透性中的重要性,强调了NAMs化合物通过抑制 MvfR活性,在维护肠粘膜完整性方面的实用性。NAMs为开发针对难治性多重耐药铜绿假单胞菌感染的关键预防和治疗单药疗法提供了可能性。

图1. 铜绿假单胞菌群体感应系统调控蛋白MvfR对急性和慢性功能的影响。

图2. NAMs有效抑制抗生素耐受细胞和生物膜形成。a. 不同NAMs化合物对PA14和PA14-∆mvfR中AT/P细胞形成影响。 b. 不同NAMs化合物对 PA14和PA14-∆mvfR生物膜形成影响。
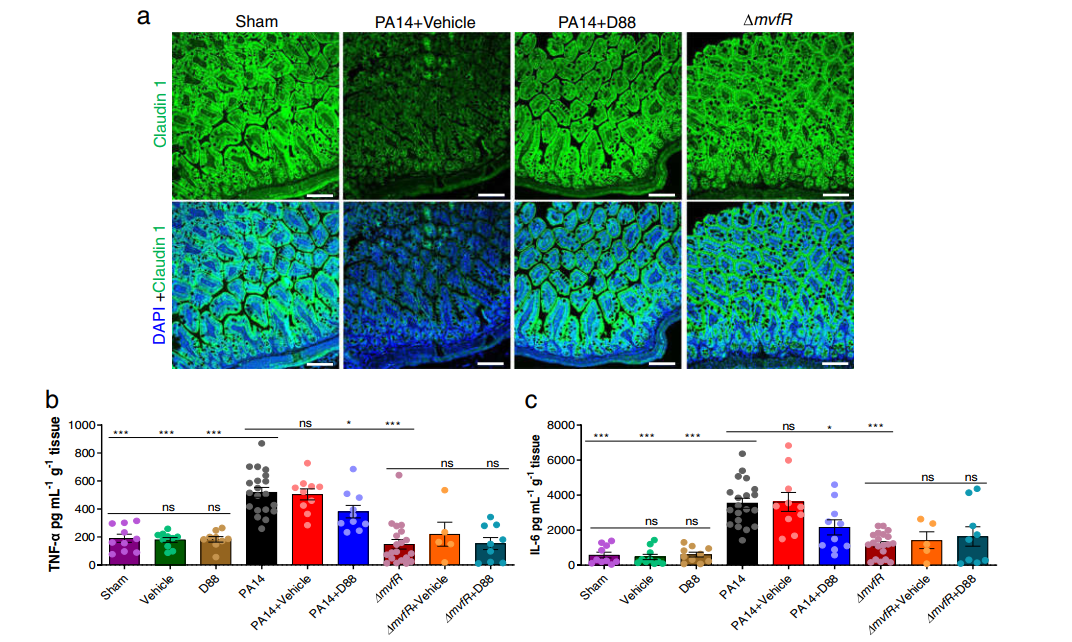
图3. 化合物 D88可减轻肠内膜的形态学改变,减轻肠道炎症。a. Claudin-1免疫荧光染色回肠远端代表性共聚焦图像(n = 2)。b. 烧伤和感染后22 h回肠远端肿瘤坏死因子(TNF-α)水平。c. 采用ELISA法定量检测回肠远端白细胞介素(IL-6)水平。
DOI: 10.1038/s41467-022-32833-9
原文链接:https://www.nature.com/articles/s41467-022-32833-9