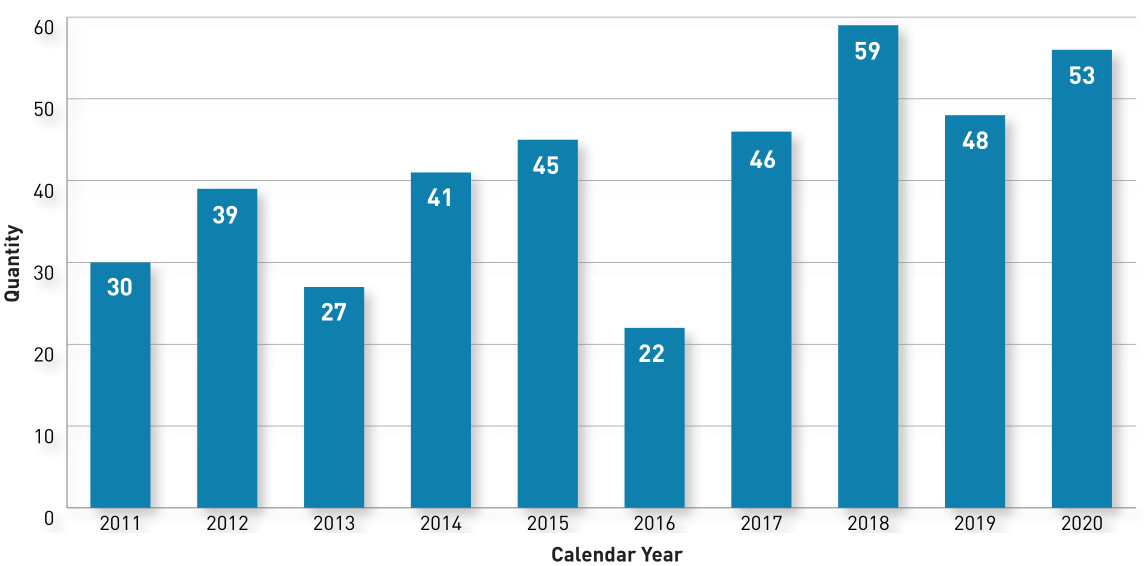
近日,美国FDA药物评估和研究中心(Center for Drug Evaluation and Research, CDER)发布了2020年度报告。在2020年,CDER批准了53个创新药,仅次于2018年的59个。
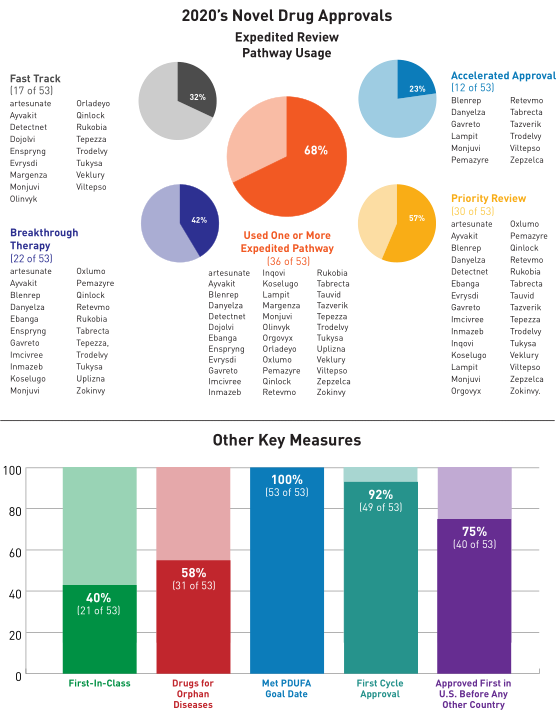
其中在53个创新药中,属于“first-in-class”疗法(具有全新作用机制)的有21个(占总数的40%),包括首个治疗COVID-19的创新药物Veklury(remdesivir 瑞德西韦),以及作为抗逆转录病毒新药的首个HIV病毒附着抑制剂 Rukobia(fostemsavir)。罕见病或孤儿病(定义为影响少于20万美国患者的疾病)新药31个(占总数的58%),包括2个治疗埃博拉病毒的新药Ebanga(ansuvimab-zykl)和Inmazeb(atoltivimab,maftivimab,odesivimab-ebgn)。
在2020年,FDA采取了多种监管措施提高创新药获批的速度和效率,经第一轮审评获批的新药占比92%,在美国首先获批的新药占比75%。在获批的创新药中,取得快速通道资格的新药占比32%;获得突破性疗法认定的新药占比42%;获得优先审评资格的新药占比57%;获得加速批准的新药占比23%。
报告下载:https://www.fda.gov/media/144982/download