铜绿假单胞菌中PvrA介导的PQS群体感应系统和PHA生物合成的调节和结构机制
作者:冯梦娜 时间:2023-10-27 点击数:
铜绿假单胞菌能够有效利用宿主组织营养物质并产生一系列蛋白质毒力因子和有毒化合物,从而引发急性和慢性感染。然而,铜绿假单胞菌通过代谢中间体产生毒性化合物的调控机制知之甚少。在2023年2月,南开大学生命科学学院微生物学系的Xiaolei Pan等人在Nucleic Acids Research(IF=14.9)上发表了题为“Regulatory and structural mechanisms of PvrA-mediated regulation of the PQS quorum-sensing system and PHA biosynthesis in Pseudomonas aeruginosa”的文章。在此之前,研究人员确定了一个名为PvrA的调控蛋白,可以调动基因参与脂肪酸分解代谢。本研究通过进一步转录组学分析,发现PvrA激活铜绿假单胞菌喹诺酮信号(PQS)合成基因,同时抑制聚羟基链烷酸酯(PHAs)编码基因的表达。当棕榈酸为唯一碳源时,结果显示pvrA突变降低了PQS合成,从而抑制了绿脓菌素和鼠李糖脂的产生,但增加了PHAs的产生。于是该团队进一步解析了PvrA与棕榈酰-CoA的共晶体结构并鉴定了棕榈酰-CoA结合残基,接着利用pvrA突变体验证了棕榈酰-CoA结合残基在响应棕榈酸基因调控中的作用。研究结果表明,PvrA控制生产的绿脓菌素和鼠李糖脂通过PQS系统响应棕榈酸,同时抑制碳和能量存储化合物聚羟基链烷酸酯(PHAs)的合成。这项研究揭示了细菌响应宿主营养物质从而促进感染发生的新机制。

图1.野生型PA 14和在FA-M9中生长的ΔpvrA突变体的转录组分析。(A)差异表达基因的KEGG富集分析。每个点的大小和颜色分别代表差异表达基因的数量和Q值范围。(B)野生型PA 14和ΔpvrA和ΔpvrA/pvrA菌株在Glu-M9或FA-M9中生长至OD 600为1.0。通过qRT-PCR测定phaG、pqsA、pqsE和phnA的相对mRNA水平。通过学生t检验,*P <0.05; **P <0.01。数据表示来自三个样品的平均值±标准偏差(SD)。

图2.PvrA直接调节PQS和PHA合成基因。(A)pqsA、phnA和phaG的启动子区中的潜在PvrA结合位点以红色显示并用实线加框。RhlR和PqsR的结合位点用虚线框出。TSS由箭头指示。数字表示起始密码子上游的距离。PpqsA-lacZ、PpqsA(-255)-lacZ、PphnA-lacZ、PphnA(-229)-lacZ、PphaG-lacZ和PphaG(-247)-lacZ转录融合体的示意图显示在各个启动子区下方。(B)携带所示lacZ转录融合体的细菌在FA-M9中生长至OD 600为1.0,随后进行β-半乳糖苷酶测定。**P <0.01; *P < 0.001,通过t检验。数据表示三个样品的平均值±SD。(C)通过EMSA检测PvrA与所示基因的启动子区域的结合。(D)棕榈酰辅酶A增强PvrA与phaG启动子区的结合。将phaG启动子片段与增加浓度的PvrA一起孵育,具有或不具有指定浓度的棕榈酰-CoA。棕榈酰-CoA-增强的PvrA-DNA相互作用由红色箭头指示。
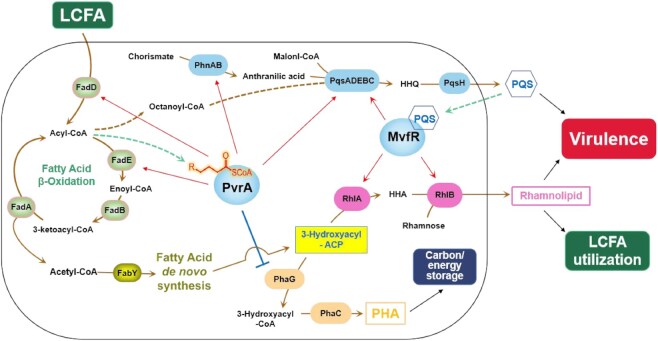
图3.PvrA介导的基因表达和碳流调控的拟议模型。LCFA通过FadD转化为脂肪酰辅酶A,然后通过β-氧化途径分解代谢(27)。在每个循环中,脂肪酰辅酶A降解为减少两个碳的脂肪酸链和乙酰辅酶A。β-氧化产生的辛酰辅酶A是合成HHQ和PQS的底物(59)。乙酰辅酶A作为脂肪酸从头生物合成的基本结构单元,其中产生3-羟酰基-ACP。PhaG和RhlA分别催化3-羟基酰基-ACP合成PHA和鼠李糖脂(68,70)。同时,PvrA与β-氧化产生的脂肪酰基-CoA结合,并激活参与脂肪酸利用(26)和PQS合成(pqsABCDE和phnAB)的基因的表达,同时抑制phaG表达。PQS合成基因的激活上调多个毒力基因,包括用于合成鼠李糖脂的rhlA和rhlB,这有助于细菌致病和LCFA的利用。通过PvrA抑制phaG表达阻断了3-羟基酰基-ACP用于PHA合成的利用,这与rhlA的上调一起将碳流导向鼠李糖脂合成。
Doi: 10.1093/nar/gkad059.
原文链接:https://pubmed.ncbi.nlm.nih.gov/36744476/