抗质粒系统驱动产碳青霉烯酶大肠杆埃希菌的抗生素耐药基因整合
作者:冉启漫 时间:2024-06-28 点击数:
抗生素耐药性是全球公共卫生的重大挑战,2019年已导致超过120万人死亡。携带抗生素耐药基因(ARG)的质粒是耐药性传播的主要途径。然而,质粒携带常伴随适应性代价,可能导致其丢失。ARG整合到染色体中可在保留耐药优势的同时减轻维持质粒的选择压力。2024年5月法国巴黎巴斯德研究所抗生素耐药性生态与进化组Isabelle Rosinski-Chupin团队在Nature Communications(IF:14.7)发表了文章“An antiplasmid system drives antibiotic resistance gene integration in carbapenemase-producing Escherichia coli lineages”,揭示了大肠杆埃希菌中一种可驱动抗性基因整合入宿主染色体的新型抗质粒系统。
该研究通过进化实验再现了碳青霉烯酶基因blaOXA-48从pOXA-48质粒向染色体的迁移,揭示了这一过程依赖于质粒诱导的适应性代价、嵌入ARG的移动遗传结构以及一种新型抗质粒系统ApsAB。研究使用了三种ST38 E. coli菌株,分别转入三种不同结构的pOXA-48质粒,观察质粒稳定性及ARG整合情况。通过28天的质粒-宿主体外进化实验,研究团队评估了质粒对宿主菌的适应性代价,并通过全基因组测序和PCR验证了ARG的整合位置和机制。研究发现,pOXA-48质粒在ST38 E. coli中诱导了显著的适应性代价,并且质粒在无抗生素环境下逐渐丢失,10天内ST38菌株中95%以上的细胞失去了质粒。结果还显示在ST38_1菌株中,blaOXA-48基因的整合频率较高,并且整合事件发生在多个染色体位置和IncFII质粒上。质粒结构影响整合频率,具有完整Tn6237转座子的pOXA-48_1质粒整合频率最高。整合了blaOXA-48的ST38_1菌株显示出显著的适应性提升,生长速率提高10-15%,且对美罗培南的最低抑制浓度下降50%。同时研究进一步发现菌株中基因位点F3141-F3140缺失可增加多个不同类型质粒的稳定性,具有相对全面的抗质粒活性,因此将其命名为一种新型抗质粒防御系统ApsAB。APsAB系统包含一个核酸酶/解旋酶蛋白和一种新型Argonaute样蛋白,能够有效去除高、低拷贝数质粒,在细菌中广泛分布,可能对质粒扩散有重要生态影响。
该研究揭示了产碳青霉烯酶大肠杆埃希菌中抗生素耐药基因整合的关键因素和机制,强调了质粒结构、宿主菌背景及抗质粒系统在ARG整合中的作用。新发现的抗质粒系统ApsAB在细菌耐药性控制和公共卫生方面具有潜在应用价值。
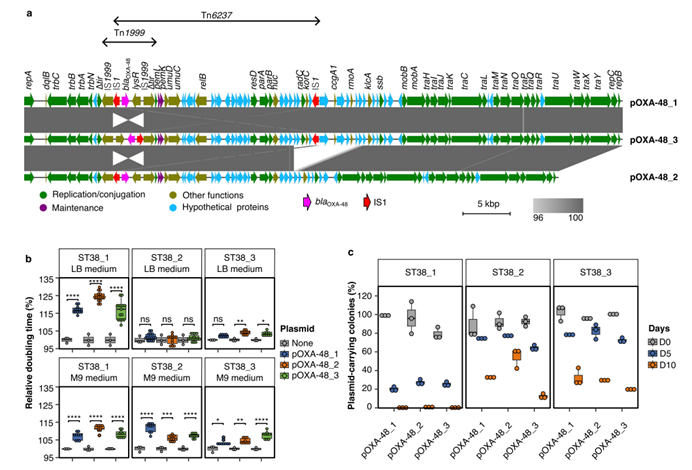
图1 ST38大肠杆菌携带pOXA-48质粒存在适应性代价和不稳定性。a. 三种pOXA-48序列比对;b. 空载菌株和质粒接合子在LB或M9培养基中相对倍增时间;c. 接合子在无抗条件下连续传代后质粒逐渐丢失。
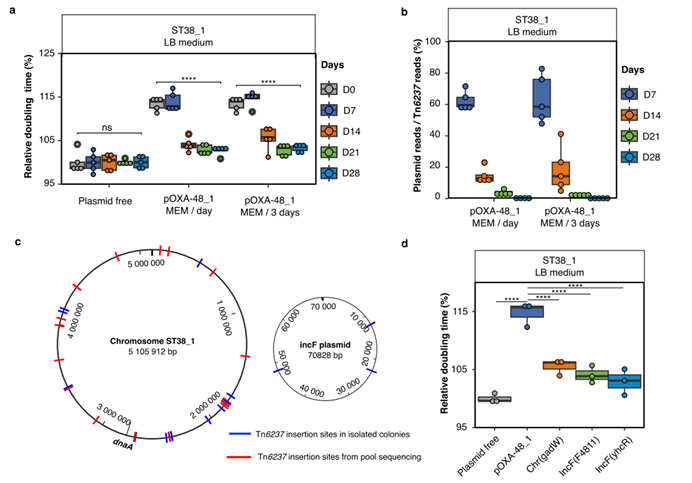
图2 接合子在进化过程中保留blaOXA-48,丢失完整质粒。a. ST38_1空载菌株和pOXA-48_1接合子在体外进化不同节点的相对倍增时间;b.不同实验条件下接合子在进化不同节点中质粒WGS定量分析;c. Tn6237介导blaOXA-48整合入染色体和质粒中;d. 空载菌株、接合子、以及染色体与内源质粒整合blaOXA-48后菌株的相对倍增时间。
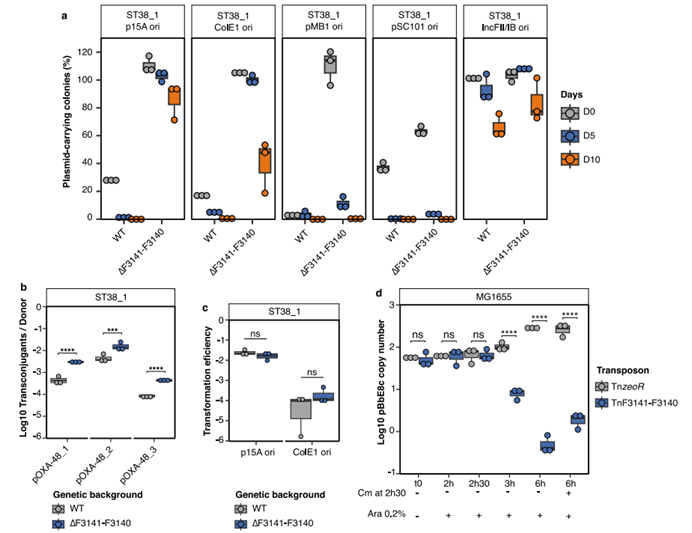
图3 ApsAB对多种低拷贝数和高拷贝数质粒具有抗质粒活性。 F3141-F3140对不同复制起点和拷贝数的五种质粒稳定性(a)、接合频率(b)、转化效率(c)的影响;d. 过表达ApsAB的菌株对ColE1质粒消除能力增加
DOI号:10.1038/s41467-024-48219-y
原文链接:https://www.nature.com/articles/s41467-024-48219-y