耐药菌感染治疗新策略:新型肽抑制剂Aqs1C成功靶向铜绿假单胞菌群体感应系统
作者:樊玉玲 时间:2025-04-25 点击数:
铜绿假单胞菌(Pseudomonas aeruginosa)是一种常见的革兰氏阴性致病菌,常引发囊性纤维化、烧伤患者等免疫力低下人群的严重感染。其多重耐药性(MDR)问题已成为临床治疗的重大挑战。传统抗生素通过直接杀灭细菌施加进化压力,易导致耐药性加速产生。群体感应系统作为细菌协调致病性的关键信号网络,虽不直接参与细菌生存,却调控生物膜形成、毒力因子分泌等致病过程。因此,干扰群体感应(即“群体淬灭”,Quorum Quenching)被视为一种低耐药风险的替代策略。
2025年1月22日 —— 国际权威期刊《International Journal of Biological Macromolecules》近日发表了一项突破性研究,来自沙特阿拉伯、埃及和英国的多国科研团队成功设计并验证了一种新型肽类抑制剂Aqs1C,该分子通过靶向铜绿假单胞菌的群体感应(Quorum Sensing, QS)调控蛋白LasR,显著抑制细菌生物膜形成及毒力因子分泌。这一发现为应对全球日益严峻的抗生素耐药性问题提供了全新思路。文章中,研究团队聚焦于铜绿假单胞菌的QS核心调控蛋白LasR。LasR通过结合自体诱导分子(如OdDHL)激活毒力基因表达,其结构的高灵活性为抑制剂设计带来挑战。此前,噬菌体来源的天然肽Aqs1已被证明可结合LasR并抑制其功能,但其较大的分子量和高免疫原性限制了临床应用。
文章中记录的研究突破是从分子设计到功能验证。研究团队以Aqs1为模板,通过精准的分子工程手段优化出更高效、稳定的肽类抑制剂Aqs1C。从两个大方面来讲,第一是结构优化与分子动力学模拟方面,其中又有三个关键点:1.关键区域筛选:通过分析Aqs1与LasR的复合物晶体结构(PDB ID: 6V7W),团队锁定Aqs1中与LasR DNA结合域相互作用的核心区域(Val-34至Leu-53,命名为Aqs1A)。2.α-螺旋稳定化:针对短肽α-螺旋的“偶极效应”,研究人员对Aqs1A的N端和C端进行“封端”修饰,分别替换为天冬氨酸(Asp)和精氨酸(Arg),得到Aqs1B,显著提升了螺旋稳定性。3.亲和力增强突变:进一步将Aqs1B的第40位精氨酸(Arg-40)突变为谷氨酸(Glu),形成Aqs1C。分子动力学模拟(800 ns)显示,Aqs1C与LasR的结合自由能(ΔGbind)达-55.65 kcal/mol,较Aqs1B(-27.67 kcal/mol)提升一倍,静电互补性(EC)评分从0.33提升至0.71,表明结合界面高度匹配。高斯加速分子动力学(GaMD)模拟进一步证实,Aqs1C可在300 ns内稳定结合LasR的DNA结合域。第二是体外实验验证抑菌效果,其中又从几个方面来验证,1.生物膜抑制:在100 μg/mL浓度下,Aqs1C对铜绿假单胞菌生物膜形成的抑制率达77.6%,优于阿奇霉素(AZM,52.7%)。2.毒力因子调控:Aqs1C显著抑制绿脓菌素(75.7%)、蛋白酶(61.1%)和鼠李糖脂(74.1%)的产生,效果均超越AZM(抑制率分别为64.6%、50.2%和57.7%)。3.安全性评估:Aqs1C对正常人肺成纤维细胞(WI38)、肝上皮细胞(THLE-2)和乳腺上皮细胞(MCF10A)的半数抑制浓度(IC50)均高于50 μg/mL,显示出良好的生物相容性。
从专家的角度出发,论文通讯作者、英国西苏格兰大学Mostafa E. Rateb教授表示:“Aqs1C的独特优势在于其‘精准打击’策略——通过干扰细菌的通讯系统而非直接杀灭,极大降低了耐药性产生的风险。这种肽类分子的小尺寸和低免疫原性为其未来临床应用奠定了基础。”沙特阿卜杜勒阿齐兹大学的Hani A. Alhadrami博士补充道:“我们的研究整合了计算生物学与实验验证,展示了多学科协作在抗感染药物开发中的重要性。下一步,我们将推进Aqs1C的体内药效和药代动力学研究,并探索其与现有抗生素的联合治疗方案。”
尽管Aqs1C在体外实验中表现优异,研究团队指出仍需解决一些挑战,例如,体内稳定性:肽类分子易被蛋白酶降解,需通过化学修饰或递送系统提升其半衰期。免疫原性评估:需在动物模型中进一步验证Aqs1C的长期安全性。耐药机制监测:尽管靶向QS系统可减少耐药压力,但仍需关注LasR基因突变等潜在逃逸机制。另外,研究团队已公开分子动力学模拟视频(Zenodo平台:https://doi.org/10.5281/zenodo.13381430),供全球同行参考。大家有兴趣可以去学习。
随着抗生素耐药性危机加剧,靶向细菌致病机制而非生存能力的“抗毒力策略”正成为研究热点。Aqs1C的成功研发不仅为铜绿假单胞菌感染提供了新型候选药物,也为其他耐药菌的治疗开辟了道路。这项研究标志着抗感染疗法从“杀菌”到“控菌”的范式转变,或将在未来十年重塑临床实践。
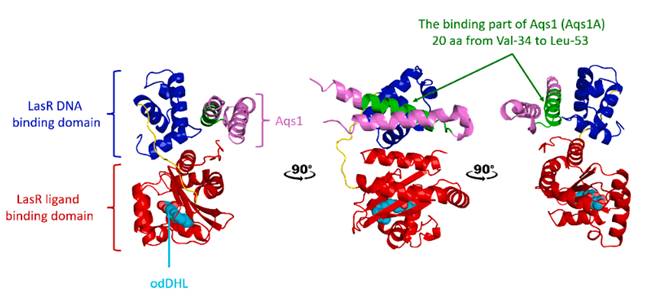
图1 与AQS1复合物中的LASR结构
指示与LASR的DNA结合结构域结合的AQS1部分(aqs1a;绿色部分)(pbpID.7W)。
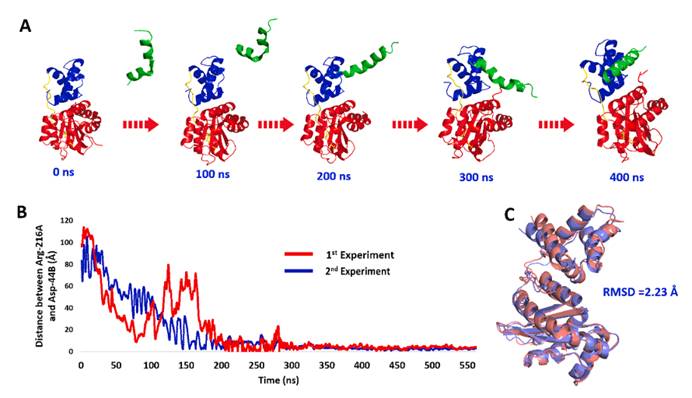
图2 A:五个不同的快照总结了AQS1C和LASR DNA域之间的结合过程快照以100 ns的间隔拍摄。B:在GAMD过程中,Arg-216a(LASR的DNA结构域的结合界面)和ASP-44B(在AQS1C的结合域上)之间的距离变化。实验进行了两次。 如图所示,AQS1C在LASR的DNA结构域周围显示出随机运动和波动,直到每个实验中≈300ns。C:初始状态与复合物的最后状态之间的结构对齐(即AQS1C-LASR; RMSD =2.23Å)。
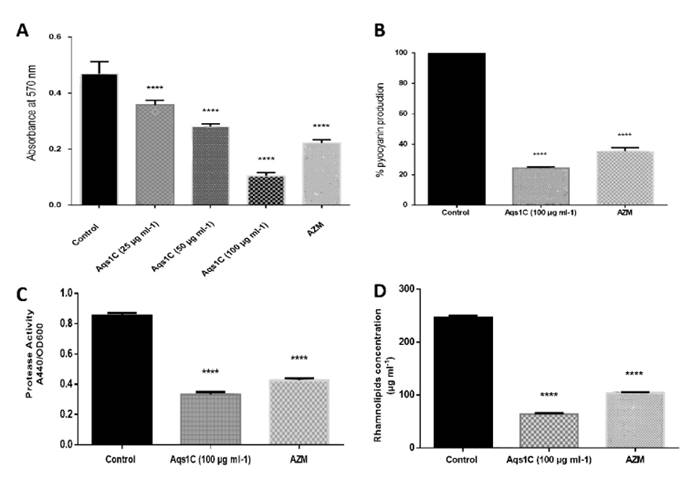
图3A:测量了不同浓度的合成肽和AZM对PA生物膜形成的影响,结果报告为570 nm时吸光度的平均值±SD。B:由于合成肽和AZM的亚米克水平而导致的PA上产生上氨酰蛋白的抑制作用。 结果表示为模素产生的平均值±SD降低百分比。C:评估了由合成肽和AZM的亚微米浓度引起的PA蛋白酶产生的降低。 结果显示为平均值±SD。D:评估了合成肽和AZM的亚微米浓度对PA rhamnolipid水平的影响。 结果表示为平均值±SD。 所有数据平均三个重复。 与未经处理的对照相比,统计显着性在p <0.05时确定。
原文链接:https://www.sciencedirect.com/science/article/pii/S0141813025006683?ref=pdf_download&fr=RR-2&rr=936c5536affaebed
DOI:10.1016/j.ijbiomac.2025.140119